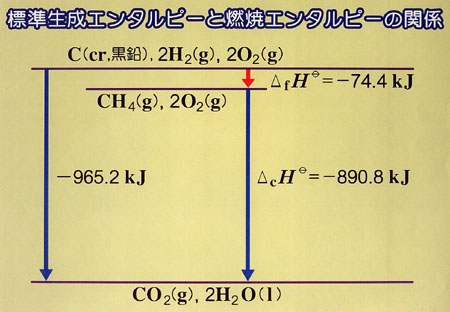
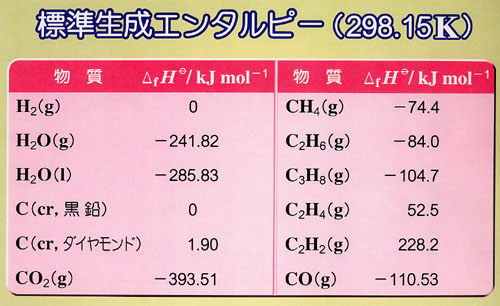
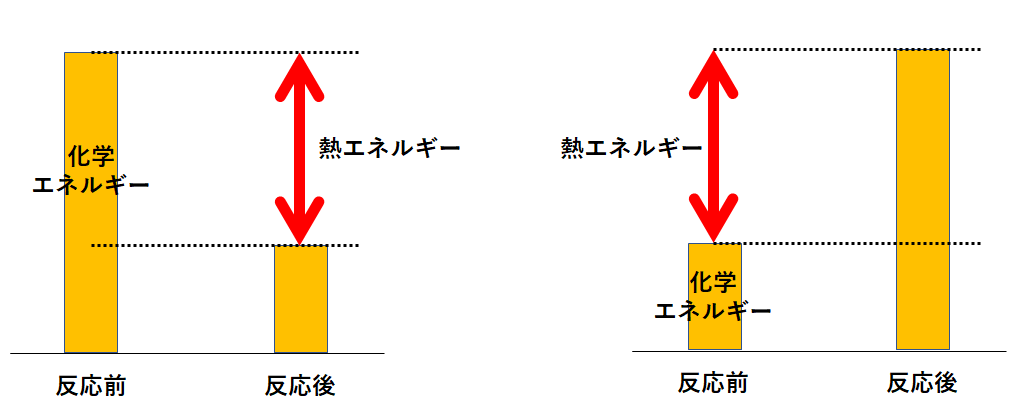
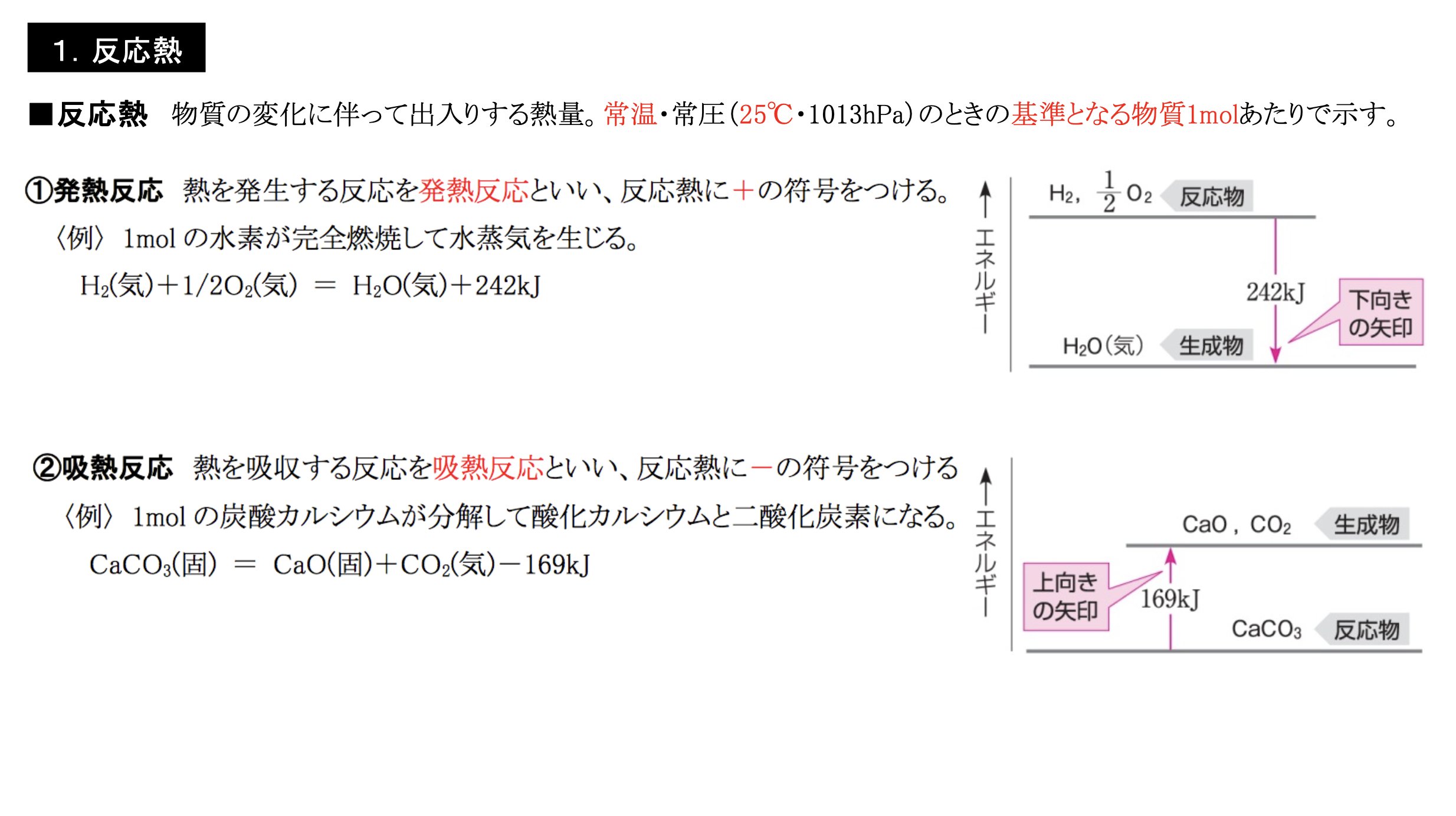
反応エンタルピー
だから、発熱のリストで 反応例 呼吸を含める必要があります。 好気性呼吸と嫌気性呼吸の場合、グルコース分子あたりそれぞれ38ATPと2ATPの放出。 好気性呼吸の場合、グルコース(食品)が酸素によって酸化されると、ほぼ3000 KJ / molのエネルギーが放出されます。 C6H12O6 6O2 = 6CO2 6H2O エネルギー イオン対の形成 イオンペアまたはイオン会合の形成は、反対の電荷を持 2NH₄Cl+Ba (OH)₂→2NH₃+BaCl₂+2H₂O 上記の反応式を覚える必要はありませんが、吸熱反応であること、アンモニアが発生することは覚えておきましょう。 アンモニアが発生するので、ぬれた紙を試験管の上にかぶせておきます。 アンモニアは水に非常に溶けやすいので、ぬれた紙の水分に溶けることになります。 この他に、 クエン酸(レモン汁) や 尿素 などの
吸熱反応 例 身近
吸熱反応 例 身近- 中に消費された 吸熱反応 エネルギー で測定されます ジュール モルあたり 反応はΔHの正の値を持っています (熱の変化) コストのため 熱の 例 177,9 j / mol, 上記の例のように 吸熱反応の例 –復元 金属の から 酸化物, –電気分解 (吸収された電気 エネルギー ), –電解解離 (例えば, 水への塩の溶解), –イオン化 –光合成, –その他 ソース吸熱反応の良い例は、塩を溶解することを含む。 それは食塩である必要はなく、溶媒も水である必要はありません。 水酸化バリウム八水和物結晶と乾燥塩化アンモニウムとの反応 塩化アンモニウムを水に溶解する 塩化チオニル(SOCl 2 )と硫酸コバルト(II)七水和物 水と硝酸アンモニウムを混合する 水と塩化カリウムを混合する。 エタン酸を炭酸ナトリウムと反応させる 光合成(葉緑素は 、二酸
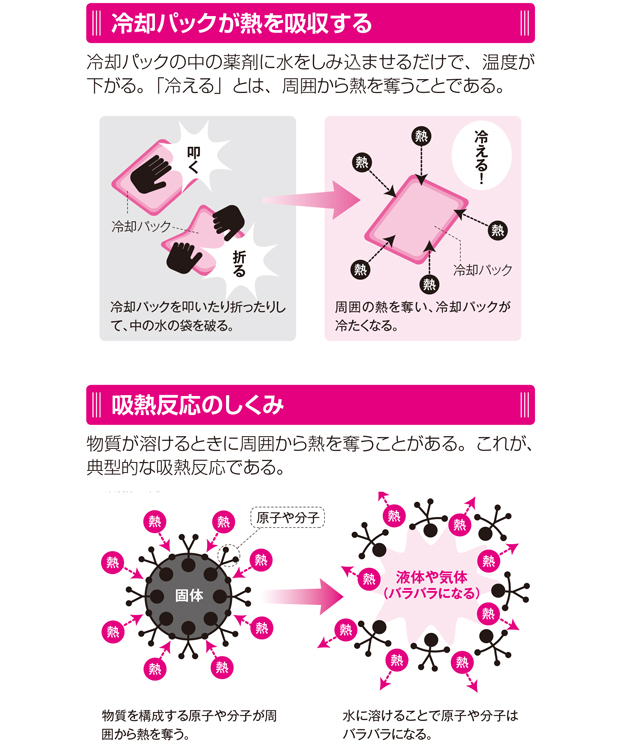
液体になると冷える 冷却パックとラムネの意外な共通点 すごい技術 毎日が発見ネット
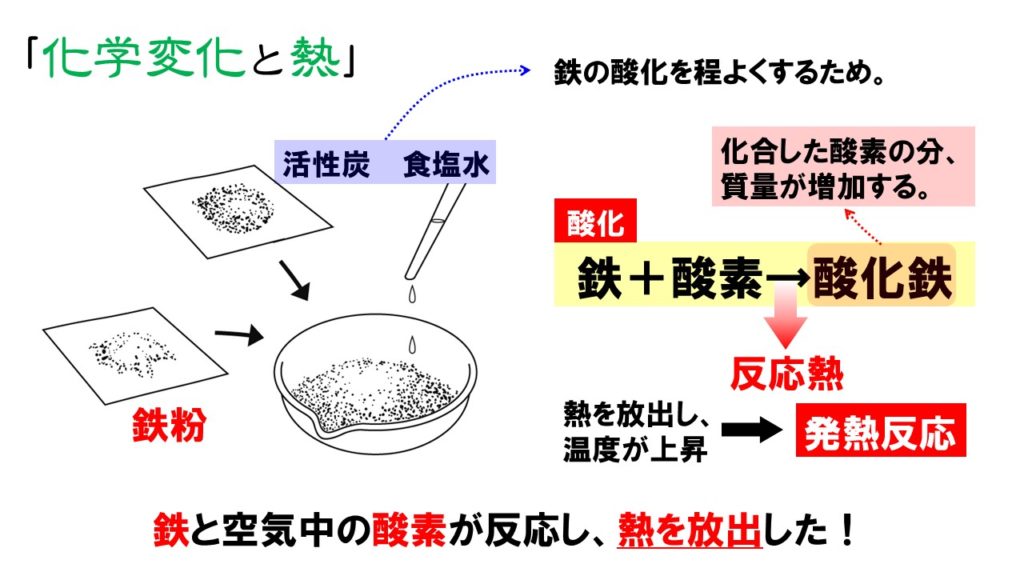
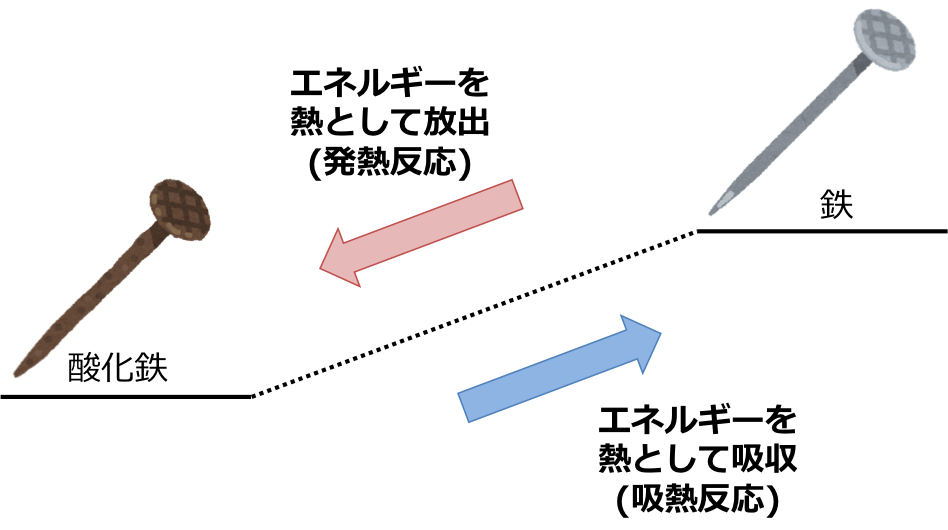
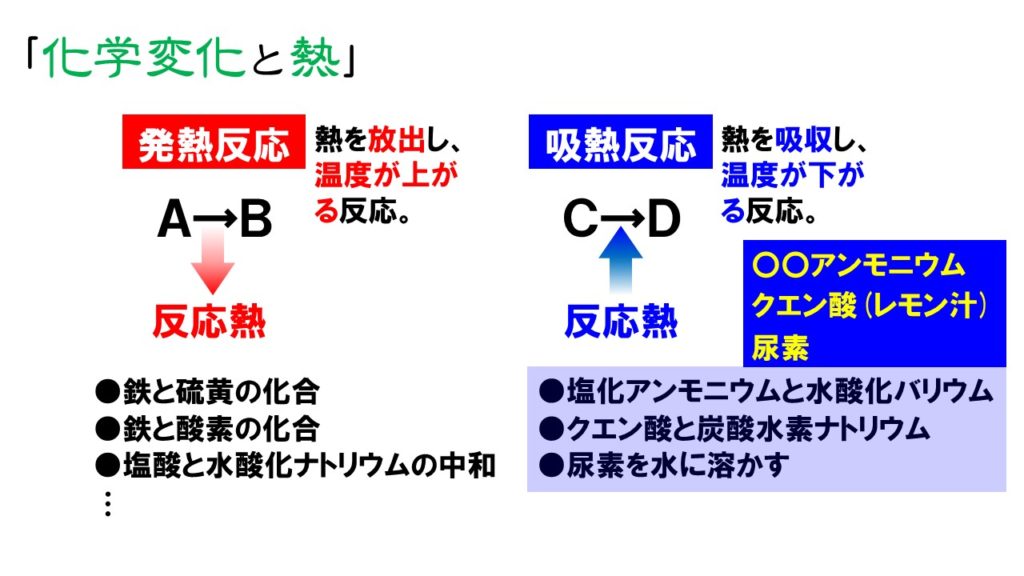
そのひとつがカイロです。 カイロの袋の中には鉄が入っており、その鉄が空気中の酸素と反応をすることで酸化鉄が精製されます。 このときに発熱がおこるので、カイロは暖かくなるという仕組みになっています。 吸熱反応 一方で化学反応によってBがAに変化したとしましょう。 このときBでは70kjのエネルギーが必要でしたが、Aに変化することで100kjのエネルギーが必要となります。 つまり百科事典マイペディア 「吸熱反応」の解説 吸熱反応きゅうねつはんのう 周囲から熱を奪って進む化学反応。 たとえば2Cl 2 +O 2 =2Cl 2 O−1264kJ。 一般に吸熱反応は自然には起こりにくく,加熱するなど 外 からエネルギーを与えてやる必要がある。 発熱反応 の逆。 ふつう見られる化学反応は発熱反応である。 出典 株式会社平凡社百科事典マイペディアについて 情報 化学辞典 第2版 「吸熱吸熱反応 (きゅうねつはんのう、 英語 :endothermic reaction)とは、物質の エネルギー を 熱 として吸収する、つまり負の 反応熱 を持つ 化学反応 のこと。 また 核反応 。 広義には 相転移 、 溶解 、混合等の 物理変化 (吸熱変化)も含める。 反応によっては熱でなく 電気 などの形でエネルギーを与えることで進行するものもある。 対義語は 発熱反応 。 吸エルゴン反応 は ギブズエネルギー を吸
吸熱反応とは どうして冷たくなったり暖かくなったりするの? 実は化学反応や物理変化が起こった際に、 多くの場合は熱の出入りが 生じています。 例えば 発熱反応 を利用した製品にはカイロがありますが、こちらは鉄の酸化反応です。 この逆反応である鉄の還元は 吸熱反応 であり、多くの熱エネルギーを加えることで酸化鉄から鉄を取り出します。 このように吸熱反応では熱を吸収吸熱反応はその名の通り熱を吸収する反応で、具体例は多くない。 だからこそ、これを押さえておけば発熱反応の暗記にも役立つだろう。 さあ、実生活における具体例を見ていこう。 化学に詳しいライターAyumiと一緒に解説していくぞ。 この記事の目次 1吸熱反応とは 2身の周りにある吸熱反応 21汗やアルコールの蒸発 22還元実験 3電気や光を吸収する反応 31電気分解 32植物の光合成一般的な吸熱反応の例 ドライアイスの蒸発 アイスクリームカートから出る白い蒸気を見た人は誰でも、吸熱性の「反応」の最も一般的な例の1つを目撃しています。 いくつかのアイスクリームを超えて、ドライアイスと呼ばれる真っ白から切り離されたこれらの蒸気も、もやの効果を生み出すためのシナリオの一部でした。 このドライアイスは、温度を吸収し、外圧が昇華し始める前の固体二酸化
吸熱反応 例 身近のギャラリー
各画像をクリックすると、ダウンロードまたは拡大表示できます
 2 |  2 | 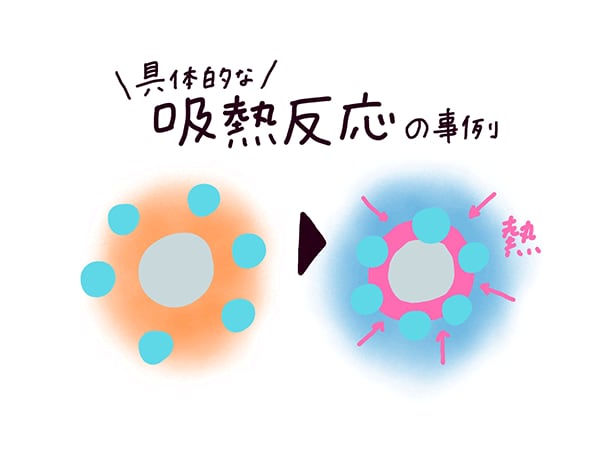 2 |
 2 | 2 |  2 |
 2 |  2 | 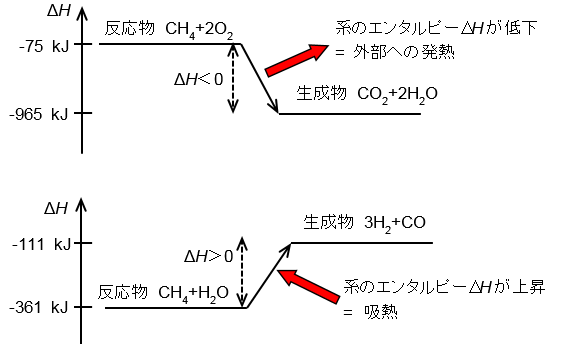 2 |
 2 | 2 |  2 |
2 |  2 | 2 |
 2 |  2 | 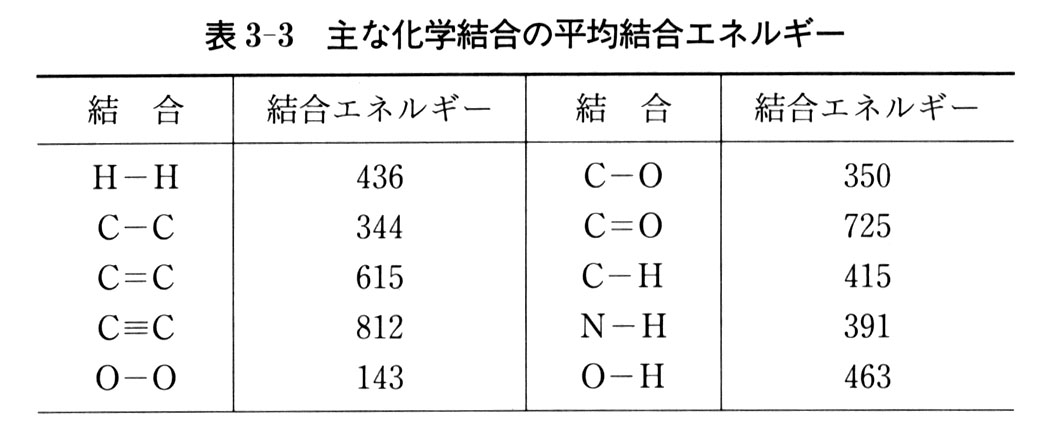 2 |
2 | 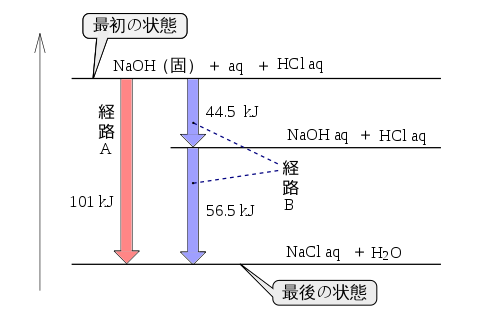 2 |  2 |
2 | 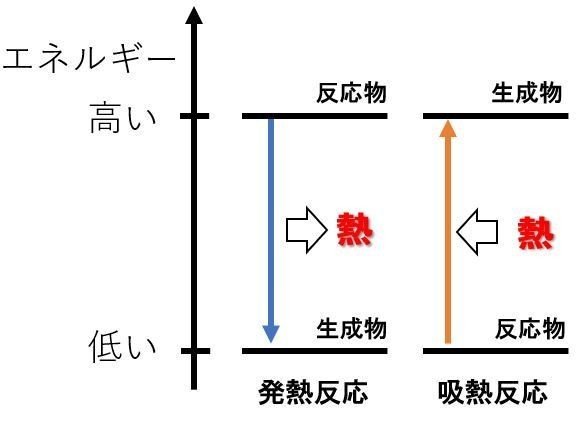 2 |  2 |
 2 |  2 | 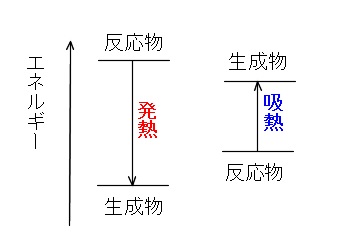 2 |
 2 | 2 |  2 |
2 |  2 |  2 |
 2 | 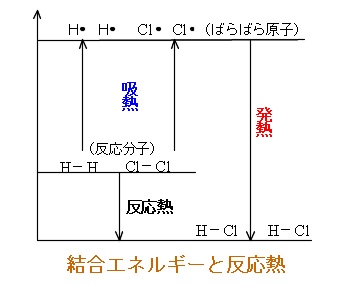 2 |  2 |
:max_bytes(150000):strip_icc()/endothermic-and-exothermic-reactions-602105_final-c4fdc462eb654ed09b542da86fd447e2.png) 2 | 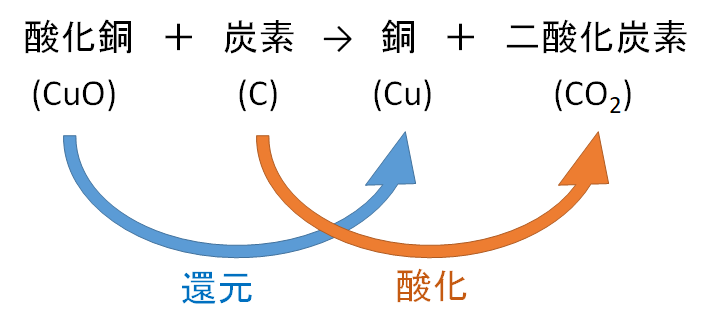 2 | 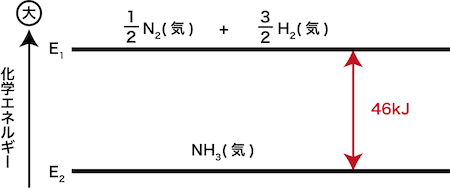 2 |
 2 |  2 |  2 |
 2 | 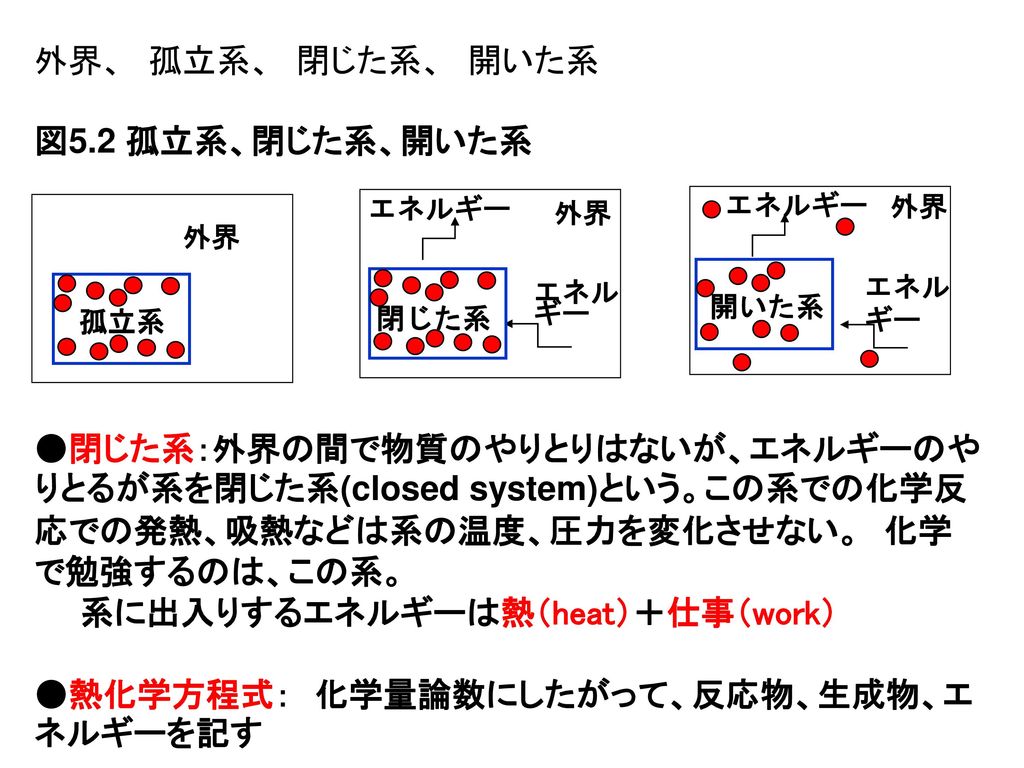 2 |  2 |
2 | 2 | 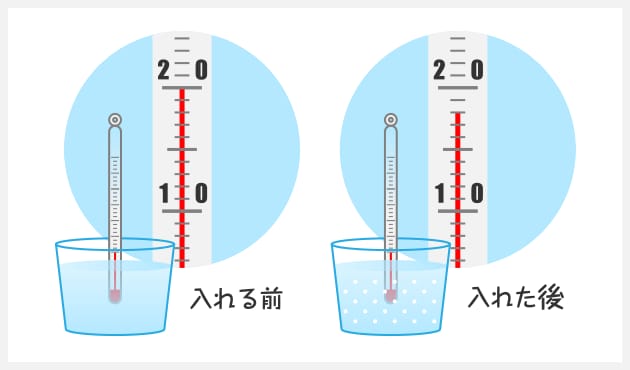 2 |
 2 | 2 |  2 |
 2 |  2 | 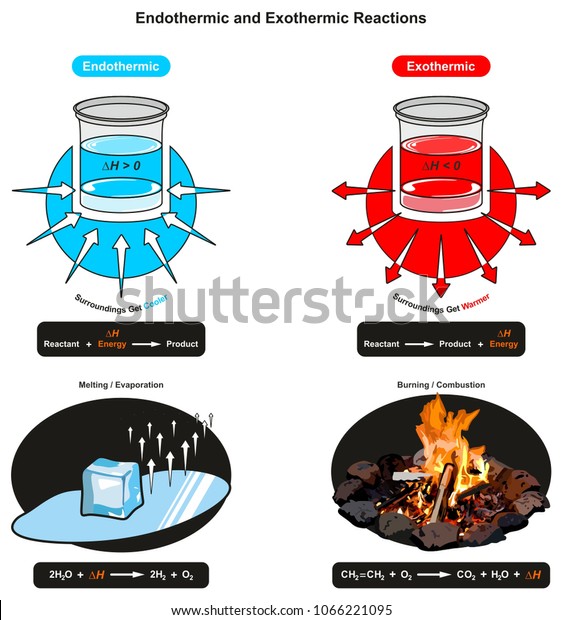 2 |
 2 | 2 | 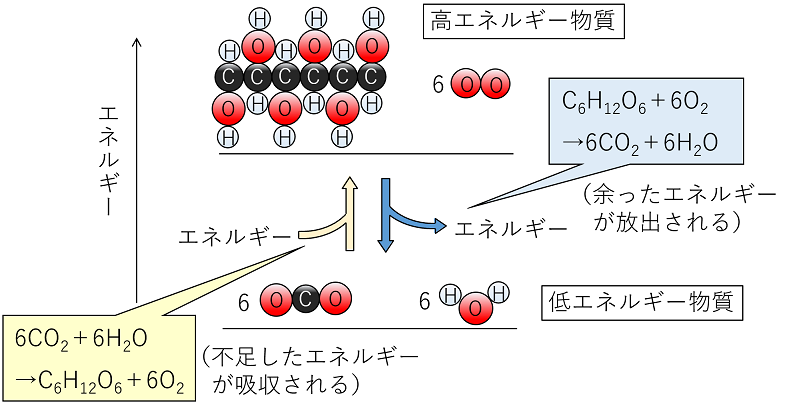 2 |
2 |  2 | 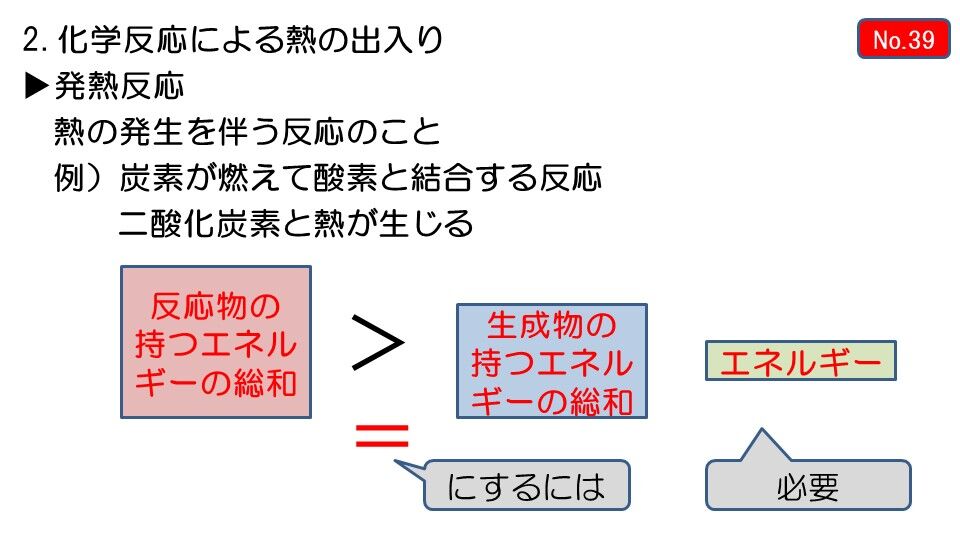 2 |
 2 | 2 | 2 |
2 |  2 | 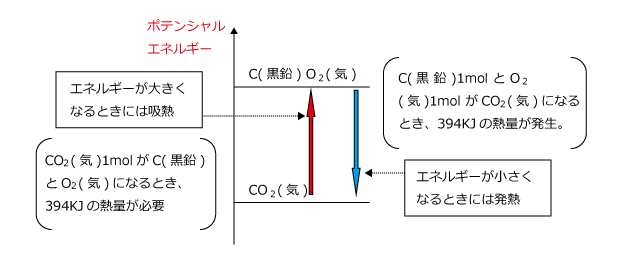 2 |
 2 | 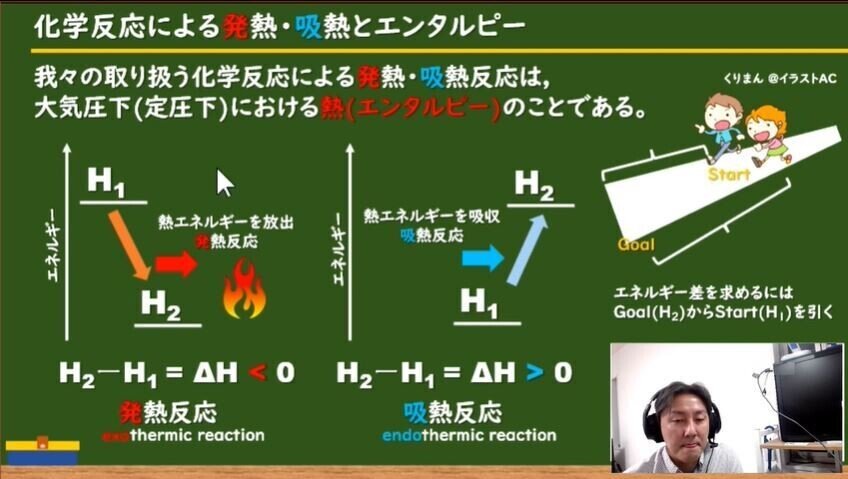 2 | 2 |
2 | 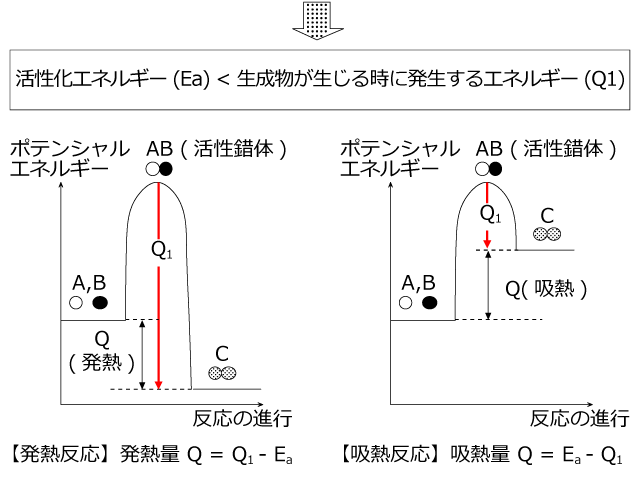 2 | 2 |
2 |  2 |  2 |
 2 | 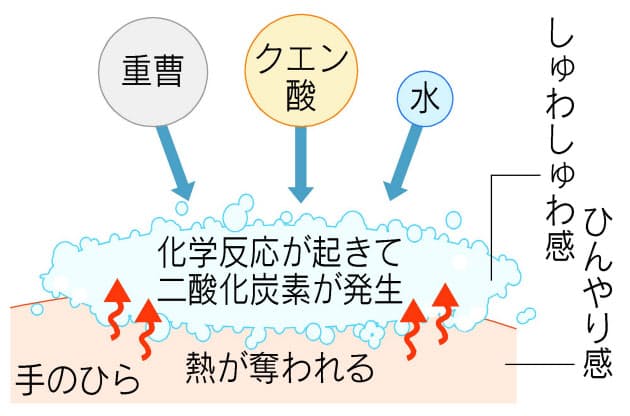 2 | 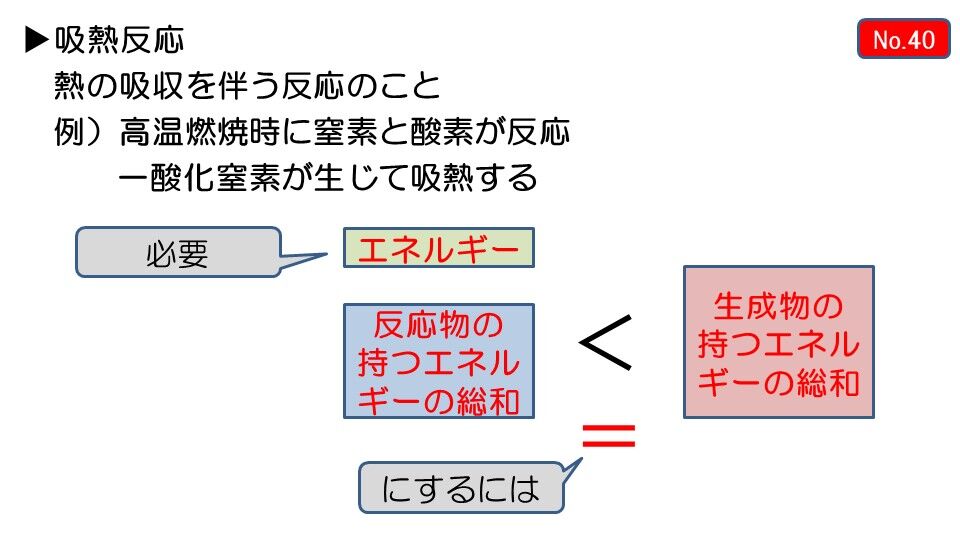 2 |
 2 | 2 |  2 |
 2 |  2 |  2 |
 2 | 2 | 2 |
 2 |  2 | 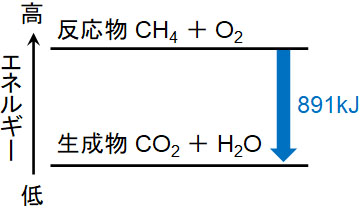 2 |
 2 |  2 | 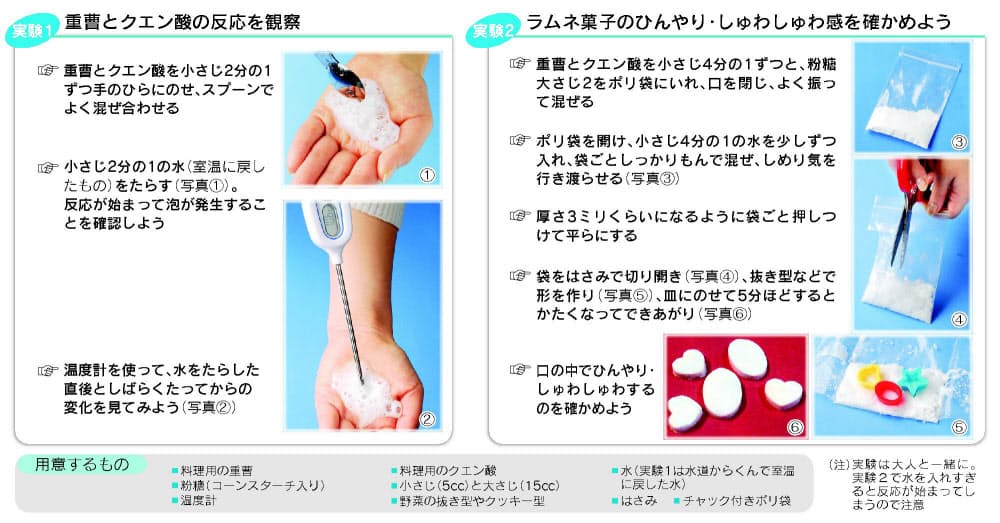 2 |
 2 | 2 | 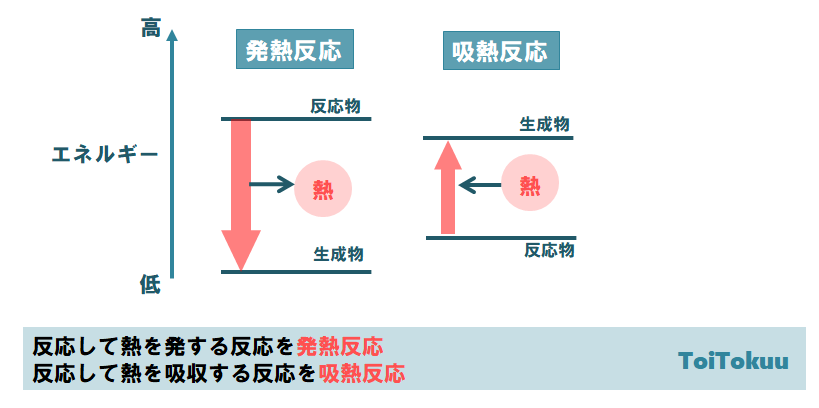 2 |
 2 |  2 |  2 |
2 | 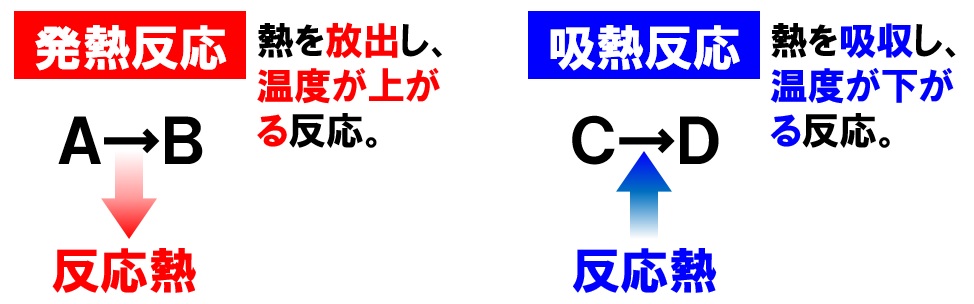 2 |  2 |
 2 | 2 |
これは、熱を加え続けなければ反応が起こらない、吸熱反応の1つです。 炭酸水素ナトリウム+熱エネルギー→炭酸ナトリウム+二酸化炭素+水 塩化アンモニウムと水酸化バリウムの反応 塩化アンモニウムと水酸化バリウムをまぜて温度を測っていきます。 すると、時間がたつごとに温度がだんだんと下がっていくことがわかりました。 周りの温度を下げる反応、これも吸熱反応です。 塩化アンモニ 吸熱反応の例 ・塩化アンモニウムと水酸化バリウムの反応 ・クエン酸と炭酸水素ナトリウムの反応 発熱反応の例 ・ 中和反応 ・ 鉄と酸素の化合 高力先生 以上です。 発熱反応と吸熱反応は高校でもしっかりと勉強する単元です。 中学生のうちから理論をしっかりと理解し用語を暗記してください。 化学反応によって化学エネルギーが生じて、 それが発熱反応や吸熱反応を起こすんだ
Incoming Term: 吸熱反応 例, 吸熱反応 例 身近, 吸熱反応 例 中学, 吸熱反応 例 高校化学, 吸熱反応 物質 例, 吸熱反応 実験 例, 生成熱 吸熱反応 例, 化学変化 吸熱反応 例, 発熱 吸熱反応 例,




No comments:
Post a Comment